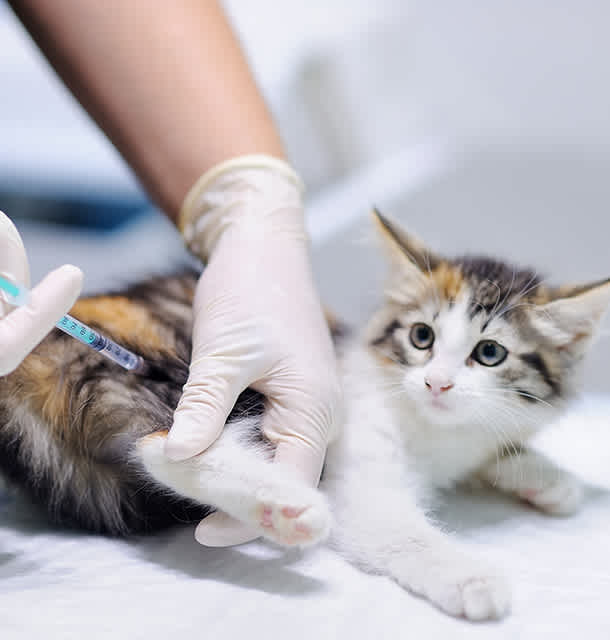
Abordaje clínico integral de las infecciones respiratorias bacterianas en perros y gatos

(Image: https://share.google/images/D5GHquz2WZxcPifQT) Overview of Bacterial Respiratory Infections in Dogs and Cats Bacterial respiratory infections (BRIs) are a key concern for veterinary clinicians, affecting both dogs and cats. They can range from mild upper respiratory disease to severe, sometimes fatal, lower respiratory infections. Common causative pathogens include: Bordetella bronchiseptica: a major pathogen in canine infectious respiratory disease complex (CIRDC) Mycoplasma species: frequently linked to chronic respiratory infections in dogs Chlamydia felis: a primary cause of conjunctivitis and upper respiratory disease in cats Neisseria animaloris: normally a commensal in the upper respiratory tract, but can occasionally cause pulmonary infections These pathogens cause inflammation and damage within the respiratory tract, making animals more susceptible to secondary infections and long-term complications. Clinical Signs and Diagnosis The clinical presentation depends on the location and severity of infection: Upper respiratory tract infections: coughing, sneezing, nasal and ocular discharge, lethargy, reduced appetite Lower respiratory tract infections: labored breathing, tachypnea, coughing, cyanosis, fever, wheezes, or crackles on auscultation Severe cases: particularly in young or immunocompromised animals, may progress to pneumonia, causing significant morbidity and mortality Diagnostic Approach A systematic approach is critical: Collect history and perform physical examination to assess onset, duration, progression, and exposure risk Use imaging such as radiographs or ultrasonography to evaluate lung involvement, pleural effusion, or consolidations Conduct laboratory tests including complete blood count and serum biochemistry to assess systemic health Perform bronchoalveolar lavage to collect lower respiratory tract samples Utilize microbiological analysis, culture and sensitivity, or PCR testing to identify causative bacterial pathogens Treatment and Supportive Care Empirical Antibiotic Therapy: Broad-spectrum antibiotics such as doxycycline may be started when the causative pathogen is unknown. Targeted Adjustments: Once culture or PCR results are available, refine the treatment plan to specifically address the identified pathogen, helping to prevent the development of antimicrobial resistance. Supportive Care: Fluid therapy to maintain hydration Oxygen supplementation for hypoxic animals Nutritional support/assisted feeding for patients with poor appetite Environmental control: isolate infected animals, and maintain proper ventilation, humidity, and air quality to ease respiratory distress Preventive Measures Vaccination: protects against Bordetella bronchiseptica in dogs and Chlamydia felis or Bordetella in cats Hygiene: regular cleaning, disinfection, and litter maintenance Isolation: separate new or sick animals in multi-pet households or shelters A comprehensive approach such as accurate diagnosis, targeted treatment, and preventive measures allows veterinary clinicians to effectively manage BRIs, reduce morbidity, and improve outcomes in dogs and cats. To help veterinary clinicians accurately diagnose respiratory infections in dogs and cats, Bioguard offers Qmini Real-time PCR Series, designed to provide fast, reliable, and actionable results. 🔎 Recommended Qmini Real-time PCR Analyzer Panels for Suspected Respiratory Infections Canine Respiratory Panel Product Name Pathogens Detected Veterinary Use Canine Respiratory Panel (4 items) Canine Distemper Virus / Canine Adenovirus Type II / Canine Parainfluenza Virus / Bordetella spp. Provides fast and accurate molecular detection of key respiratory pathogens, supporting precise diagnosis and targeted treatment in dogs Feline Respiratory Panel Product Name Pathogens Detected Veterinary Use Feline Respiratory Panel (4 items) Feline Calicivirus / Feline Herpesvirus / Chlamydia felis / Mycoplasma felis Enables rapid identification of common feline respiratory pathogens, assisting veterinarians in accurate diagnosis and management 📌 Note for Veterinarians: For purchase, please contact our sales team or customer service to receive professional consultation and ordering details. 📩 How to Order All rapid test kits listed above are available exclusively to licensed veterinarians and veterinary hospitals. To place an order or request a quotation, please contact our sales team or email our customer service: 📧 service@bioguardlabs.com ☎️ Please include your hospital name and contact number in the email so our sales representative can follow up with you directly.
Desentrañando el desafío: Diagnóstico en clínica de la mortal peritonitis infecciosa felina (PIF)

¿Qué es el PIF? La peritonitis infecciosa felina (PIF) es una de las enfermedades más difíciles de diagnosticar en gatos. Está causada por una mutación del coronavirus felino común (FCoV). En la mayoría de los gatos, este virus solo provoca infecciones intestinales leves o incluso asintomáticas. Si embargo, en algunos casos, el virus muta y se convierte en PIF. Formas de la enfermedad El PIF se presenta en dos formas: efusiva (húmeda) y no efusiva (seca). PIF Húmedo causa acumulación de líquido en las cavidades corporales. Esto puede genera distensión abdominal (vientre hinchado) o derrame pleural (líquido en el tórax). PIF Seco provoca la formación de granulomas inflamatorios en órganos como los ojos, el cerebro o los riñones. Esto suele manifestarse con signos neurológicos o problemas oculares. Dado que los síntomas son muy variables, el PIF puede ser difícil de reconocer. ¿Cómo hacen los veterinarios el diagnóstico? El diagnóstico se basa en una combinación de la historia clínica del gato, edad, raza, signos clínicos y resultados de laboratorio. Los gatos jóvenes y de raza pura son los más afectados. Los signos clínicos inespecíficos incluyen fiebre persistente, pérdida de peso y letargo. Si los tratamientos convencionales no funcionan, el veterinario puede sospechar de PIF. Los análisis de sangre suelen mostrar cambios como: Niveles elevados de globulinas Proteína total elevada Relación albúmina / globulina baja A veces, conteo bajo de linfocitos Estos hallazgos apoyan el diagnóstico, pero no confirman el PIF. En el caso de PIF húmedo, el análisis del líquido acumulado puede aportar pistas importantes. El fluido suele tener un alto contenido proteico pero baja celularidad. La prueba de Rivalta puede realizarse rápidamente en la clínica, aunque no es muy específica. Confirmación de la enfermedad Las pruebas definitivas incluyen RT-PCR para detectar el ARN del FCoV, y pruebas de tejidos (immunohistoquímica o immunofluorecencia) para identificar antígenos virales. Estás pruebas son especialmente útiles en casos de PIF seco. Sin embargo, la PCR no siempre permite distinguir entre el FCoV no patógeno y la forma mutada que causa el PIF. Por ello, los resultados deben interpretarse junto con los hallazgos clínicos y de laboratorio. Estudios de imagen como ecografías o resonancias magnéticas pueden ayudar a localizar órganos afectados o acumulaciones de líquido. También orientan a los veterinarios sobre dónde recolectar muestras para análisis citológico o histopatológico. El desafío del diagnóstico En la práctica, diagnosticar el PIF rara vez es sencillo. Se requiere combinar evidencia proveniente de los signos clínicos, las pruebas de laboratorio y las imágenes diagnósticas, en lugar de depender de una única prueba. Los veterinarios deben equilibrar la urgencia del tratamiento con las limitaciones de las herramientas diagnósticas actuales. El futuro del diagnóstico del PIF Un diagnóstico definitivo de PIF en la práctica es pocas veces completamente certero. Más bien, se trata de un análisis probabilístico basado en la combinación de signos clínicos, resultados de laboratorio e imágenes, en lugar de una sola prueba concluyente. Los veterinarios deben sopesar la urgencia del tratamiento frente a las limitaciones de los métodos diagnósticos actuales, valorando tanto los hallazgos que respaldan la sospecha como aquellos que la confirman, para guiar sus decisiones clínicas. Las investigaciones en curso sobre pruebas rápidas de antígenos, PCR en el punto de atención y nuevos biomarcadores podrían mejorar tanto la velocidad como la precisión del diagnóstico del PIF. Estos avances podrían brindar a los veterinarios herramientas más confiables para enfrentar esta enfermedad consistentemente grave. Reference: GSEPEM. (n.d.). [Image from website]. GSEPEM. https://gsepem.com/?g=404111816 Productos recomendados para el Tamizaje en casos sospechosos de PIF Nombre del producto Propósito en el diagnóstico PIF Uso Veterinario Prueba FCoV Ab Detecta exposición al coronavirus felino (FCoV), el virus precursor del PIF Ayuda a identificar gatos con riesgo de mutación PIF Prueba FCoV Ag Detecta antígenos activos del coronavirus en gatos Apoya la evaluación del estado actual de la infección. Kit de detención de peritonitis Ayuda a identificar PIF efusiva (húmeda) a través de análisis de líquidos. Útil en casos sospechosos de PIF húmeda con derrame abdominal o torácico. Feline 3X (FeLV Ag / FIV Ab / FCoV Ab) Prueba combinada para retrovirus (FeLV, FIV) y anticuerpos contra coronavirus. Proporciona un perfil inmunosupresivo más amplio, ya que las coinfecciones pueden complicar el pronóstico del PIF. Feline 3DX (FPV Ag / FCoV Ag / Giardia Ag) Detecta antígenos de FCoV junto con FPV y Giardia. Útil en el diagnóstico diferencial cuando hay diarrea o enfermedad sistémica que se superpone con PIF. Prueba Toxoplasma IgM/IgG Ab Prueba para toxoplasmosis, un diagnóstico diferencial importante en signos neurológicos u oculares del PIF. Ayuda a descartar enfermedades que imitan el PIF seco. Kit de tipificación sanguínea felina Determina el tipo de sangre antes de una transfusión en casos graves de PIF con anemia. Herramienta de apoyo para el manejo clínico avanzado Nota para veterinarios: For purchase, please contact our sales team or customer service at [insert email/contact info] to receive professional consultation and ordering details. Para realizar una compra, por favor contacte a nuestro equipo de ventas o al servicio al cliente (email) para recibir asesoría profesional y detalles sobre cómo realizar su pedido. Como Ordenar Todos los kits de prueba rápida mencionados anteriormente están disponibles exclusivamente para veterinarios licenciados y hospitales veterinarios. Para realizar un pedido o solicitar una cotización, comuníquese con nuestro equipo de ventas o envíe un correo a: service@bioguardlabs.com Por favor incluya el nombre de su hospital y su número de contacto en el correo, para que nuestro representante de ventas pueda comunicarse con usted directamente.
Neoplasia: The Danger of Feline Leukemia Virus
Feline Leukemia Virus (FeLV) remains one of the most consequential retroviruses affecting domestic cats, not only due to its immunosuppressive effects but also its strong association with neoplastic diseases. Among FeLV-positive cats, neoplasia—particularly lymphoma—is a leading cause of mortality. 1. How does FeLV Causes Cancer? FeLV integrates its RNA into the host’s DNA, altering cellular control mechanisms. This can activate oncogenes or disrupt tumor suppressor genes, leading to unchecked cell proliferation. Unlike other viruses, FeLV has a unique ability to directly induce tumor formation, particularly in hematopoietic and lymphoid tissues. 2. Common Types of FeLV-Associated Tumors Lymphoma: The most common neoplasm in FeLV-positive cats, particularly mediastinal, multicentric, and spinal forms. Leukemia: Especially acute lymphoblastic leukemia (ALL), often aggressive and rapidly progressive. Other Neoplasms: Less commonly, FeLV is associated with fibrosarcomas, myeloproliferative disorders, and osteochondromas. 3. Patient Profile and Risk Factors Age: FeLV-related tumors tend to develop in younger cats, often under 5 years of age. Transmission: FeLV spreads through saliva, nasal secretions, and close contact—making multi-cat environments particularly risky. Co-factors: Immunosuppression, co-infections (e.g., FIV), and genetic predisposition may worsen outcomes. 4. Clinical Signs: Generalized lymphadenopathy Dyspnea (especially with mediastinal involvement) Pale mucous membranes, anemia Weight loss, lethargy Neurologic deficits (with spinal lymphoma) GI signs (vomiting, diarrhea, melena) 5. Diagnostic tests: FeLV Testing: Rapid Test, ELISA and PCR testing to confirm infection status. Imaging: Thoracic radiographs, ultrasound, or CT scans for mass detection. Cytology/Histopathology: Fine needle aspirates or biopsies to confirm neoplastic origin. 6. Prevention: Vaccination: FeLV vaccines are effective at reducing infection rates, especially in high-risk populations. Routine Testing: Especially important for kittens, newly adopted cats, and multi-cat households. Environmental Control: Keeping FeLV-positive cats indoors and separated from uninfected cats. FeLV is not only an infectious threat but a potent oncogenic driver. Understanding its role in feline neoplasia underscores the importance of screening, prevention, and early intervention.
Urinary Tract Infections (UTIs) in Dogs: Why my…?

Urinary tract infections (UTIs) are common in dogs and can affect their comfort, health, and behavior. In this article, we will address the common questions that dog owners have regarding their dog urination. Early detection and treatment are essential to prevent complications such as kidney infections or bladder stones. 🔍 What is a UTI in Dogs? A urinary tract infection is typically caused by bacteria (most commonly Escherichia coli) from the rectum, skin, or hair near the entering the urethra and multiplying into the bladder. Less commonly, fungi, virus or other pathogens may be involved. UTIs can affect the lower urinary tract (bladder and urethra) or upper urinary tract (ureters and kidneys). Lower UTIs are more common and less severe, while upper UTIs is very dangerous and can be life-threatening. 🧬 Causes Bacterial contamination (e.g., from feces or environment) Poor hygiene, especially in long-haired or incontinent dogs Urinary retention (not urinating frequently) Underlying health problems: Diabetes mellitus Cushing’s disease Kidney disease Bladder stones or tumors Weakened immune system Congenital abnormalities of the urinary tract 🚨 Clinical Signs Some dogs show clear symptoms, while others may be asymptomatic, especially early on. Pet owners should watch for: Frequent urination (pollakiuria) Straining or pain while urinating Small amount or no urine (dysuria) Blood in urine (hematuria) Cloudy color or foul-smelling urine Accidents in the house (even if previously house-trained) Licking the genital area excessively Fever or lethargy (in severe or kidney-involved infections) Loss of appetite 🩺 Diagnosis A veterinarian will typically perform: Urinalysis – to check for bacteria, white blood cells, pH, crystals Urine culture and sensitivity test – to identify the exact bacteria and the most effective antibiotic Blood tests – to assess kidney function or underlying illness Imaging (X-ray or ultrasound) – if stones, tumors, or structural abnormalities are suspected 💊 Treatment Antibiotics – prescribed based on culture results Pain relief / anti-inflammatories Increased water intake – to flush the urinary system Dietary changes – especially if crystals or stones are present Surgery – in cases of tumors, large stones, or anatomical issues 🔄 Recurring UTIs Recurrent infections may signal underlying problems. Your vet might recommend: Advanced imaging Endoscopy Long-term antibiotic therapy Immune function testing 🛡️ Prevention Tips Ensure clean drinking water at all times (Flowing water is preferred) Encourage regular potty breaks Maintain proper hygiene, especially in long-haired breeds Regular vet checkups, especially for senior dogs Control underlying conditions like diabetes or bladder stones
Desenmascara la propagación: ¿Cómo viaja y crece la resistencia a los antibióticos?

La resistencia a los antibióticos ya no es solo un problema del cuidado de la salud humano – es una amenaza compartida tanto entre los campos médico y veterinario. Como veterinarios, estamos en la primera línea, donde el uso responsable de antibióticos puede marcar una diferencia crítica. Pero ¿cómo se desarrolla y se propaga exactamente la resistencia a los antibióticos? Vamos a desglosarlo. Paso 1: Uso de antibióticos en animales El viaje comienza en las granjas, donde animales como gallinas, cerdos y vacas reciben antibióticos de forma rutinaria. Esto puede ser a través de alimentos medicados o terapias para enfermedades. Aunque esto ayuda a prevenir enfermedades y promover el crecimiento, también tiene un efecto secundario peligroso – las bacterias en el sistema de los animales pueden volverse resistentes a los antibióticos. Estas bacterias resistentes se transportan en el cuerpo y los desechos de los animales. Paso 2: Contaminación a través de alimentos y agua Los desechos animales, ricos en bacterias resistentes, a menudo se utilizan como fertilizante o llegan a fuentes de agua. Los cultivos que crecen en este entorno pueden contaminarse. Estas bacterias pueden permanecer en la superficie o dentro de los cultivos, llegando al sistema digestivo humano al ser consumidos. Paso 3: Propagación a través del consumo de carne Las bacterias resistentes a los medicamentos también pueden encontrarse en la carne cruda. Si no se manipula o cocina apropiadamente, estas bacterias pueden transmitirse a los humanos, sumando otro punto de entrada para la propagación de la resistencia en la población. Paso 4: Resistencia en la comunidad Una vez dentro del cuerpo humano, las bacterias resistentes pueden establecerse y multiplicarse. Por ejemplo, alguien como «John» puede tomar antibióticos e inconscientemente albergar bacterias resistentes en su sistema. Luego interactúa con otras personas en su casa o comunidad, propagando inadvertidamente estas bacterias. Paso 5: Ampliación en centros de salud La situación empeora si John busca atención médica en un hospital o residencia para mayores. Estos entornos suelen albergar personas vulnerables y emplear tratamientos intensivos con antibióticos. Aquí, las bacterias resistentes pueden propagarse directamente entre pacientes o indirectamente, a través de manos contaminadas del personal de salud y superficies sucias. Estos centros, destinados a curar, pueden convertirse en focos de propagación de gérmenes resistentes. Paso 6: El ciclo se repite Cuando los pacientes regresan a casa, pueden seguir portando y trasmitiendo bacterias resistentes, perpetuando el ciclo. A medida que estas bacterias viajan de los animales a los alimentos, a las personas, a los hospitales y de regreso a la comunidad, la resistencia a los antibióticos continúa creciendo y evolucionando. Responsabilidad veterinaria Para frenar la propagación: Utilizar antibióticos solo cuando sea necesario y con un diagnóstico adecuado. Seguir estrictos protocolos de higiene en clínicas y granjas. Educar a los clientes sobre la importancia de seguir el tratamiento correctamente y los riesgos del uso indebido. Apoyar el cuidado preventivo, como las vacunas y una buena nutrición, para reducir el riesgo de infecciones. Estando informados y vigilantes, los veterinarios desempeñamos un papel crucial en la preservación de la eficacia de los antibióticos – tanto para animales como para personas.
Enfermedad de von Willebrand (vWD) en perros.

La enfermedad de von Willebrand (vWD) es el trastorno hereditario de coagulación más común en los perros. Está causada por una deficiencia o disfunción de una proteína específica de la coagulación sanguínea llamada factor von Willebrand (vWF). Está proteína ayuda a que las plaquetas sanguíneas se adhieran entre sí para sellar los vasos sanguíneos dañados y detener el sangrado. Sin una cantidad suficiente de vWF funcional, los perros con vWD pueden experimentar hemorragias excesivas o prolongadas. Hay 3 tipos de enfermedad de von Willebrand: Tipo 1: Hay cantidades bajas de proteínas de vWF con una estructura normal. Tipo 2: Algunas proteínas vWF están presentes, pero tienen una estructura anormal y no funcionan de manera adecuada. Tipo 3: Hay pocas o ninguna proteína vWF disponible; esta es la forma más grave de la enfermedad. Signos y Síntomas Los síntomas de vWD pueden variar desde leves a graves. Los signos más comunes incluyen: Sangrado Nasal Encías sangrantes Sangrado prolongado después de una cirugía o lesión Presencia de sangre en la orina o las heces Tendencia a formar hematomas con facilidad. Diagnóstico y Tratamiento Un veterinario puede diagnosticar la vWD mediante análisis de sangre, como el conteo sanguíneo completo, pruebas químicas y el perfil de coagulación, los cuales miden los niveles del vWF y la capacidad de coagulación. También se dispone de pruebas de ADN para identificar a los portadores, especialmente en razas propensas a esta enfermedad. No existe una cura para la vWD, pero los casos leves a menudo no requieren tratamiento. En los casos más graves, los veterinarios pueden utilizar medicamentos como acetato de desmopresina (DDAVP) o realizar transfusiones de sangre para controlar los episodios de sangrado. Es importante evitar medicamentos como la aspirina, la heparina o los antibióticos de tipo sulfa, ya que pueden agravar el sangrado. Prevención Las prácticas de crianza responsable son clave para reducir la propagación de vWD. Los criadores deben realizar pruebas a sus perros para detectar la enfermedad y evitar reproducir animales afectados.
¿Por qué son los gatos más propensos al CKD (Enfermedad Renal Crónica)?

La enfermedad renal crónica (CKD) puede afectar a gatos de cualquier edad, pero se diagnóstica con mayor frecuencia en gatos de mediana edad y en gatos geriátricos, típicamente mayores de siete años. Hay varias razones que pueden causar CKD, entre ellas: 1. Proceso Natural de Envejecimiento: A diferencia de los perros, cuyos riñones tienden a fallar debido a infecciones o condiciones hereditarias, la CKD en los gatos suele estar relacionada con el desgaste gradual de los riñones a lo largo de los años. 2. Bajo impulso de sed: Los gatos evolucionaron a partir de animales del desierto y naturalmente tienen un bajo impulso de sed. Esto significa que no beben tanta agua como deberían, lo que genera una carga adicional a sus riñones. 3. Metabolismo Proteico: Los gatos requieren una dieta rica en proteínas, pero sus riñones deben filtrar los desechos derivados del metabolismo proteico. Con el tiempo, esto puede contribuir al daño renal. 4. Factores Genéticos: Algunas razas, como el Persa, el Siamés y el Abisinio tienen una mayor predisposición genética a desarrollar una enfermedad renal. 5. Progresión Silenciosa: La CDK en los gatos suele pasar desapercibida debido a que sus síntomas no son notables – como la pérdida de peso, el aumento de la sed y la orina – se desarrolla de forma lenta. Cuando un gato es diagnosticado, la enfermedad generalmente ya se encuentra en una etapa avanzada.
Protegiendo a tu cachorro: El Moquillo Canino

El moquillo canino es una enfermedad viral altamente contagiosa y potencialmente fatal, causada por el virus del moquillo canino (CDV), miembro de la familia Paramyxoviridae. A pesar de los avances en vacunación, esta enfermedad sigue siendo una amenaza significativa, especialmente en perros no vacunados y en poblaciones silvestres como zorros, lobos, mapaches y zorrillos. Patogénesis El CDV afecta principalmente los sistemas respiratorio, gastrointestinal y nervioso central. Tras la infección inicial por gotas respiratorias, el virus se replica en el tejido linfático del tracto respiratorio, conduciendo a una viremia. Si la respuesta inmunitaria es insuficiente, el virus se disemina hacia los tejidos epiteliales y nerviosos, causando una enfermedad multisistémica. Signos Clínicos La presentación clínica del moquillo canino puede variar considerablemente, dependiendo de la etapa de la infección y los sistemas afectados. Los signos comunes incluyen: Respiratorio: Secreción nasal, tos y neumonía. Gastrointestinal: Vómitos y diarrea Neurológico: Convulsiones, ataxia, mioclono (contracciones musculares involuntarias), y cambios conductuales. Dermatológico: Hiperqueratosis de las almohadillas plantares y del planum nasal («hard pad disease»). Algunos perros pueden presentar signos leves, mientras que otros desarrollan un compromiso sistémico grave. Los signos neurológicos pueden aparecer semanas o incluso meses después de la recuperación inicial. Diagnóstico El diagnóstico preciso requiere una combinación de anamnesis, signos clínicos y pruebas de laboratorio: Anamnesis: Contacto con perros no vacunados o infectados. Imágenes: Radiografías torácicas pueden revelar signos de neumonía. Pruebas de laboratorio: Pruebas de PCR de hisopado (conjuntival, nasal o faríngeo) Pruebas rápidas para CDV – anticuerpos y antígenos específicos. Citología: Detección de cuerpos de inclusión en células epiteliales o frotis sanguíneos. Tratamiento No existe un tratamiento antiviral específico para el CDV. Tratamiento se basa en cuidados de apoyo: Terapia de fluidos: Para corregir la deshidratación y los desequilibrios electrolíticos. Antibióticos: Para prevenir o tratar las infecciones bacterianas secundarias. Anticonvulsivos: Para controlar las convulsiones. Soporte nutricional: Para contrarrestar la anorexia y la pérdida de peso. El pronóstico es variable; los perros con signos respiratorios o gastrointestinales leves pueden recuperarse, mientras que aquellos con afectación neurológica grave suelen tener un pronóstico reservado o desfavorable. Prevención y Control La prevención se basa principalmente en la vacunación, la cual es altamente efectiva y esencial tanto para cachorros como para perros adultos no vacunados. Los cachorros deben recibir su primera vacuna contra el moquillo entre las 6 y 8 semanas de edad, seguida por dosis de refuerzo según las recomendaciones del veterinario. El control de la propagación incluye el aislamiento de animales infectados, el mantenimiento de una buena higiene en perreras y espacios comunes y evitar el contacto entre mascotas no vacunadas y animales potencialmente infectados. La concienciación pública y los chequeos veterinarios regulares son clave para reducir los brotes y proteger la salud canina.
Protegiendo a los perros de la amenaza de la Leptospirosis

La leptospirosis es una enfermedad bacteriana zoonótica causada por espiroquetas patógenas del género Leptospira. Afecta a una gran variedad de mamíferos, incluidos los animales domésticos, silvestres y los humanos. Leptospira son espiroquetas gramnegativas aerobias, caracterizadas por su movilidad helicoidal. Estas bacterias crecen lentamente y pueden sobrevivir durante semanas o meses en ambientes cálidos y húmedos, como suelos con orina empozada o aguas estancadas. La leptospirosis se trasmite principalmente a través de la orina de animales infectados, especialmente roedores, aunque los perros y otros animales infectados también pueden actuar como portadores. Los perros infectados pueden parecer clínicamente sanos mientras continúan eliminando la bacteria en la orina, representando un riesgo para otros animales y para los humanos. · ¿Cómo se infectan los perros? Los perros suelen infectarse con la bacteria Leptospira cuando esta penetra el organismo a través de mucosas (ej. boca, nariz u ojos) o por lesiones en la piel, como cortes o rasguños. Las formas comunes de trasmisión incluyen: Exposición directa: Contacto con orina, agua contaminada o tejidos infectados. Contaminación ambiental: Orina estancada en el suelo, comida, cama o agua estancada. Situaciones poco comunes: La bacteria también puede trasmitirse por medio de la reproducción, mordidas de animales infectados o través de la placenta de una madre infectada a sus cachorros. · Signos Clínicos de la Leptospirosis en Perros La leptospirosis puede causar una variedad de signos clínicos, que van de leves a graves. Los síntomas comunes incluyen: Pérdida de apetito Vómitos Letargo Dolor abdominal Diarrea Ictericia (color amarillento en piel, encías u ojos) Deshidratación Poliuria, oliguria, hematuria o anuria. Epistaxis, melena y hematemesis Pérdida de peso Rigidez o dolor muscular Si no se trata, la leptospirosis puede progresar a condiciones graves y potencialmente mortales como: Falla renal: enfermedad renal crónica, diabetes insípida nefrogénica, acidosis tubular renal. Insuficiencia hepática: niveles elevados de ALP, ALT, bilirrubina. Enfermedad pulmonar grave: hemorragia pulmonar. Trastorno hemorrágico: melena, hematuria, epistaxis, hematemesis y hemorragias petequiales en encías y membranas mucosas. · Prevención de la Leptospirosis La prevención de la leptospirosis en perros requiere reducir su exposición a la bacteria Leptospira e implementar estrategias preventivas efectivas, como: Vacunación contra la Leptospira. Limitar la exposición a ambientes de riesgo como aguas estancadas o de lento movimiento (estanques, lagos) y el contacto con fauna silvestres, especialmente en zonas de alto riesgo. Controlar la población de roedores ya que son los principales portadores de la Leptospira. Limpiar y desinfectar las áreas donde los perros pueden estar en contacto con orina, especialmente en perreras, parques para perros o casas con múltiples perros. Realizar chequeos veterinarios regulares para detectar signos tempranos de leptospirosis y garantizar un tratamiento oportuno si la ocurre la infección.
